适应性免疫系统是人们能够在多病原体环境下健康生存的主要保障,也是免疫力的主要“动力输出”。适应性免疫系统主要由T、B 淋巴细胞组成,而在淋巴细胞发育早期会经历由RAG1/2 复合物起始的抗原受体基因的DNA 的VDJ 重排,从而产生多样性的抗原受体并最终决定了适应性免疫系统识别抗原的能力1,2。而淋巴细胞发育的异常往往会导致免疫缺陷疾病并严重影响患者的健康和生活质量。
抗原受体基因的重排过程涉及到RAG 蛋白复合物与DNA 的识别、切割和重组, DNA或者组蛋白的修饰被认为参与了这个过程的精密调控。然而我们对表观遗传修饰如何影响VDJ 重排及抗原受体多样性的产生仍然认识有限。2019 年7 月26 日,上海交通大学医学院附属仁济医院朱鹤、上海交大生物医学工程学院高维强、李力及复旦大学附属儿科医院孙金峤合作在Nature Communications 在线发表了研究成果The histone methyltransferase Setd2 is indispensable for V(D)J recombination,该工作发现了组蛋白H3K36me3 甲基化转移酶Setd2 在淋巴细胞谱系发育中的重要作用,揭示了H3K36me3 的表观遗传修饰在VDJ 重排过程中不可或缺。
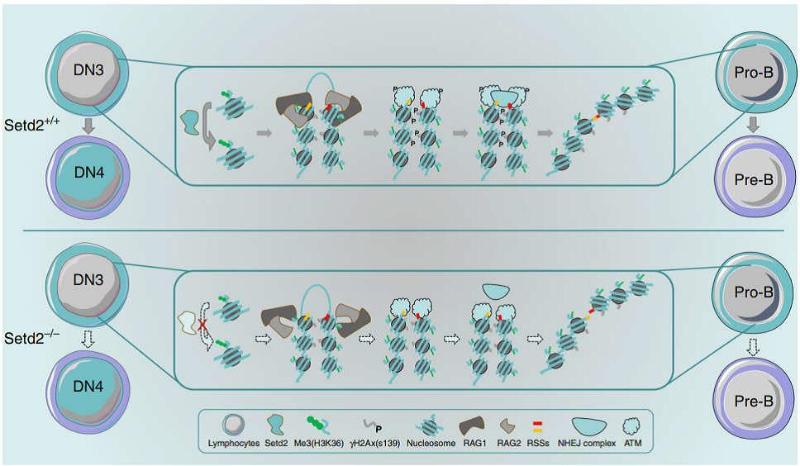
该研究通过利用多种转基因小鼠模型,分别在造血系统、T 淋巴细胞和B 淋巴细胞中敲除Setd2 基因,发现该基因缺失都导致了分化的淋巴细胞数量和比例的急剧减少。进一步通过分析前体淋巴细胞的发育情况发现T、B 淋巴细胞在VDJ 重排时期发育受阻。通过ChIP、RNA-seq 等技术研究者发现Setd2 缺失导致的淋巴细胞发育受阻是由于该基因缺失后使得抗原受体基因的H3K36me3 水平降低,导致Rag1 蛋白在抗原受体基因的重组位点上的识别能力降低,且DNA 损伤修复信号受损。这两方面的因素使Setd2 缺失的T/B 前体细胞中Rag1 蛋白不能高效的介导重组位点DNA 的断裂,且断裂的DNA 不能被有效的修复,最终导致VDJ 重排缺陷,T/B 淋巴细胞发育受阻。通过分析大规模免疫缺陷病人的突变信息,研究者在未知病因的免疫缺陷病人当中鉴定出Setd2 的失活突变,进一步为临床诊断与治疗这一类疾病提供了可靠的靶点和理论依据3。
该研究的第一作者为上海交通大学生物医学工程学院的博士研究生吉忠忠。该研究也得到了仁济医院血液科侯健主任和沈丽菁主任医师的大力支持。

原文链接:https://doi.org/10.1038/s41467-019-11282-x
参考文献
1. von Boehmer, H. & Melchers, F. Checkpoints in lymphocyte development and autoimmune disease. Nat. Immunol. 11, 14–20 (2010).
2. Rothenberg, E. V. Transcriptional Control of Early T and B Cell Developmental Choices. Annu. Rev. Immunol. 32, 283–321 (2014).
3. Ji, Z. et al. The histone methyltransferase Setd2 is indispensable for V(D)J recombination. Nat. Commun. 10, 3353 (2019).
李力
生物医学工程学院
